Μετάφραση/Επιμέλεια: Σίμος Δαλυριάδης
“Real life Experience of Medical Cannabis Treatment in Autism”
Lihi Bar-Lev Schleider(1,2), Raphael Mechoulam(3), Naama Saban(2), Gal Meiri(4,5), Victor Novack(1)
(1) Κλινικό Ινστιτούτο Ερευνών για την Κάνναβη, Ιατρικό Κέντρο Πανεπιστημίου Soroka και Σχολή Επιστημών Υγείας, Πανεπιστήμιο Bengurion του Negev, Be’er-Sheva, Ισραήλ.
(2) Τμήμα Ερευνών, Tikun Olam LTD, Τελ Αβίβ-Γιάφο, Ισραήλ.
(3) Ινστιτούτο Έρευνας για τα Ναρκωτικά, Φαρμακευτική Σχολή, Εβραϊκό Πανεπιστήμιο της Ιερουσαλήμ, Ιερουσαλήμ, Ισραήλ.
(4) Negev Κέντρο Αυτισμού, Πανεπιστήμιο του Negev του Μπεν Γκουριόν, Μπέρ Σέβα, Ισραήλ.
(5) Ιατρική Σχολή Πανεπιστημίου Soroka και Σχολή Επιστημών Υγείας, Πανεπιστήμιο Bengurion του Negev, Beer Sheva, Ισραήλ. Η αλληλογραφία και τα αιτήματα για υλικά πρέπει να απευθύνονται στη διεύθυνση V.N. (email: VictorNo@clalit.org.il)
Scientific Reports Volume 9, Article number: 200 (2019)
https://www.nature.com/articles/s41598-018-37570-y
Περίληψη
“Έχει σημειωθεί δραματική αύξηση του αριθμού των παιδιών που διαγνώστηκαν με διαταραχές στο φάσμα του αυτισμού. ΔΦΑ(autism spectrum disorders, ASD) παγκοσμίως. Πρόσφατα έχουν προκύψει ανεπίσημες ενδείξεις πιθανών θεραπευτικών επιδράσεων των προϊόντων της κάνναβης. Σκοπός αυτής της μελέτης είναι ο χαρακτηρισμός της επιδημιολογίας των ασθενών με ΔΦΑ που λαμβάνουν θεραπεία με κάνναβη και η περιγραφή της ασφάλειας και της αποτελεσματικότητάς της. Αναλύσαμε τα δεδομένα που συλλέχθηκαν προοπτικά ως μέρος του προγράμματος θεραπείας 188 ασθενών με ΔΦΑ που έλαβαν κάνναβη για ιατρικούς σκοπούς μεταξύ του 2015 και του 2017. Η θεραπεία στην πλειονότητα των ασθενών βασίστηκε σε έλαιο κάνναβης που περιείχε 30% CBD και 1,5% THC. Το απόθεμα συμπτωμάτων (symptoms inventory), η συνολική αξιολόγηση ασθενών (patient global assessment) και οι ανεπιθύμητες παρενέργειες (side effects) σε 6 μήνες ήταν πρωταρχικά αποτελέσματα ενδιαφέροντος και αξιολογήθηκαν με δομημένα ερωτηματολόγια. Μετά από έξι μήνες θεραπείας, 82,4% των ασθενών (155) ήταν σε ενεργό θεραπεία και 60,0% (93) αξιολογήθηκαν. 28 ασθενείς (30,1%) ανέφεραν σημαντική βελτίωση, 50 (53,7%) μέτριες, 6 (6,4%) ελαφρές και 8 (8,6%) δεν είχαν καμία αλλαγή στην κατάστασή τους. Είκοσι τρεις ασθενείς (25,2%) παρουσίασαν τουλάχιστον μία ανεπιθύμητη παρενέργεια, με την πιο συχνή να ήταν η ανησυχία (6,6%). Η κάνναβη στους ασθενείς με ΔΦΑ φαίνεται να είναι καλά ανεκτή, ασφαλής και αποτελεσματική επιλογή για την ανακούφιση των συμπτωμάτων που σχετίζονται με την ΔΦΑ”.
Υπήρξε τριπλάσια αύξηση κατά τις τελευταίες 3 δεκαετίες στον αριθμό των παιδιών που διαγνώστηκαν με διαταραχές στο φάσμα του αυτισμού παγκοσμίως(1-5). Δεν υπάρχουν επί του παρόντος διαθέσιμες ειδικές θεραπείες και οι παρεμβάσεις επικεντρώνονται στη μείωση των καταστροφικών συμπεριφορών, στην κατάρτιση και στη διδασκαλία δεξιοτήτων αυτοβοήθειας για μεγαλύτερη ανεξαρτησία(6).
Πρόσφατα, η εμπλουτισμένη με CBD κάνναβη έχει αποδειχθεί ωφέλιμη για τα παιδιά με αυτισμό(7). Σε αυτή την αναδρομική μελέτη σε 60 παιδιά, βελτιώθηκαν τα συμπεριφορικά κρούσματα στο 61% των ασθενών, τα προβλήματα επικοινωνίας σε 47, το άγχος στο 39%, το στρες σε 33 και η διαταραχή στη συμπεριφορά σε 33 ασθενείς. Το σκεπτικό αυτής της θεραπείας βασίζεται στις προηγούμενες παρατηρήσεις και τη θεωρία ότι τα αποτελέσματα της κανναβιδιόλης μπορεί να περιλαμβάνουν την ανακούφιση έναντι της ψύχωσης, του άγχους, την διευκόλυνση του ύπνου REM και την καταστολή της δραστηριότητας επιληπτικών κρίσεων(8). Μια προοπτική μελέτη με μοναδική περίπτωση με dronabinol (φάρμακο που βασίζεται στην συνθετική THC) έδειξε σημαντικές βελτιώσεις στην υπερδραστηριότητα, τον λήθαργο, την ευερεθιστότητα, τη στερεοτυπία και την ακατάλληλη ομιλία σε παρακολούθηση 6 μηνών(9). Επιπλέον, η θεραπεία με dronabinol σε 10 έφηβους ασθενείς με νοητική αναπηρία είχε ως αποτέλεσμα 8 ασθενείς να εμφανίζουν βελτίωση στη διαχείριση ανθεκτικής στη θεραπεία συμπεριφοράς αυτοτραυματισμού(10).
Το 2007, το Israel Ministry of Health (Υπουργείο Υγείας του Ισραήλ) άρχισε να παρέχει εγκρίσεις για την ιατρική χρήση της κάνναβης, κυρίως για την ανακούφιση των συμπτωμάτων. Το 2014, το Υπουργείο Υγείας επίσης άρχισε να παρέχει άδειες και για τη θεραπεία παιδιών με επιληψία. Αφού είδαν τα αποτελέσματα της θεραπείας με την κάνναβη σε συμπτώματα όπως άγχος, επιθετικότητα, πανικό, κρίσεις και αυτοτραυματική συμπεριφορά, σε παιδιά με επιληψία, οι γονείς με αυτιστικά παιδιά στράφηκαν στην ιατρική χρήση της κάνναβης για ανακούφιση.
Αν και πολλοί με αυτισμό αντιμετωπίζονται σήμερα με την ιατρική χρήση της κάνναβης, υπάρχει σημαντική έλλειψη γνώσης σχετικά με το προφίλ ασφάλειας και τα συγκεκριμένα συμπτώματα που είναι πιθανότερο να βελτιωθούν στο πλαίσιο της θεραπείας με κάνναβη. Ως εκ τούτου, στόχος αυτής της μελέτης ήταν ο χαρακτηρισμός του πληθυσμού των ασθενών που έλαβαν ιατρική θεραπεία με κάνναβη για αυτισμό και η αξιολόγηση της ασφάλειας και της αποτελεσματικότητας αυτής της θεραπείας.
Αποτελέσματα
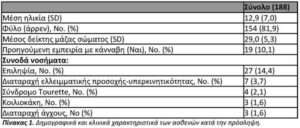
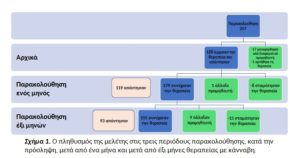
Πληθυσμός ασθενών.Κατά τη διάρκεια της περιόδου μελέτης, 188 ασθενείς με ΔΦΑ άρχισαν την θεραπεία. Η διάγνωση της ΔΦΑ έγινε σύμφωνα με την αποδεκτή πρακτική στο Ισραήλ. Έξι επικεφαλής παιδίατροι ψυχίατροι και νευρολόγοι ήταν υπεύθυνοι για τη θεραπεία 125 ασθενών (80,6), ενώ τα υπόλοιπα 30 παιδιά αναφέρθηκαν από άλλους 22 γιατρούς. Στον Πίνακα 1 παρουσιάζονται τα δημογραφικά χαρακτηριστικά του πληθυσμού των ασθενών. Η μέση ηλικία ήταν 12,9 ± 7,0 έτη, με 14 (7,4%) ασθενείς ηλικίας κάτω των 5 ετών, 70 ασθενείς (37,2%) μεταξύ 6 έως 10 ετών και 72 (38,2%) ηλικίας 11 έως 18 ετών. Οι περισσότεροι από τους ασθενείς ήταν άρρενες (81,9%). Είκοσι επτά ασθενείς (14,4%) υπέφεραν από επιληψία και 7 ασθενείς (3,7%) από Διαταραχή Ελλειμματικής Προσοχής-Υπερκινητικότητας (ΔΕΠ-Υ).
Κατά την έναρξη της μελέτης οι γονείς των 188 ασθενών ανέφεραν κατά μέσο όρο 6,3 ± 3,2 συμπτώματα. Ο Πίνακας 2 δείχνει την επικράτηση των συμπτωμάτων με τις πιο συχνές να είναι η υπερικινητικότητα (90,4%), οι εκρήξεις οργής (79,8%) και η ανησυχία 78,7.
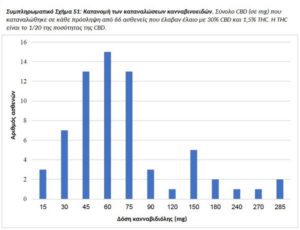
Τα προϊόντα κάνναβης που συνιστώνται στους ασθενείς ήταν κυρίως το έλαιο που εφαρμόστηκε κάτω από την γλώσσα (94,7). Επτά ασθενείς (3,7%) έλαβαν άδεια αγοράς ελαίου και φυτικού υλικού (μπουμπούκια) και τρεις ασθενείς (1,5%) έλαβαν άδεια να αγοράσουν μόνο φυτικό υλικό. Οι περισσότεροι ασθενείς κατανάλωναν έλαιο με 30% CBD και 1,5% THC, κατά μέσο όρο 79,5 ± 61,5mg CBD και 4,0 ± 3,0mg THC, τρεις φορές την ημέρα (για πιο λεπτομερή κατανομή των καταναλώσεων CBD/THC, βλ. Συμπληρωματικό Σχήμα. S1). Με αϋπνία καταγράφηκαν 46 ασθενείς (24,4%) που υποβλήθηκαν σε θεραπεία με βραδινές δόσεις ελαίου THC 3% με κατά μέσο όρο επιπλέον 5,0 ± 4,5mg THC ημερησίως. Όλα τα περιεχόμενα των προϊόντων επικυρώθηκαν με HPLC (High Performance Liquid Chromatography, Υψηλής Απόδοσης Υγρή Χρωματογραφία) σε κάθε κύκλο παραγωγής. Η δόση κάνναβης δεν συσχετίστηκε σημαντικά με το βάρος (συντελεστής συσχέτισης r = 0,13, p = 0,30), την ηλικία (r συντελεστής συσχέτισης = 0,10, p = 0,38) ή το φύλο (p = 0,38).
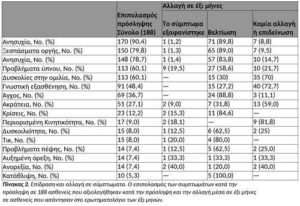
Παρακολούθηση, ενός μηνός. Μετά από ένα μήνα, από τους 188 ασθενείς, 8 (4,2%) σταμάτησαν τη θεραπεία, 1 (0,5%) άλλαξε σε διαφορετικό προμηθευτή κάνναβης και 179 ασθενείς (94,6%) συνέχισαν την ενεργό θεραπεία (Εικόνα 1). Από την τελευταία ομάδα, 119 (66,4%) απάντησαν στο ερωτηματολόγιο 58 ασθενείς (48,7%) που ανέφεραν σημαντική βελτίωση, 37 (31,1) με μέτρια βελτίωση, 7 ασθενείς (5,9) είχαν ανεπιθύμητες ενέργειες και 17 (14,3) ανέφεραν ότι η κάνναβη δεν τους βοήθησε.
Οι ανεπιθύμητες παρενέργειες που αναφέρθηκαν σε ένα μήνα ήταν: υπνηλία (1,6%), κακή γεύση και μυρωδιά του ελαίου (1,6%), ανησυχία (0,8%), παλινδρόμηση (0,8%) και έλλειψη όρεξης (0,8%).
Παρακολούθηση, έξι μηνών. Μετά από έξι μήνες, από τους 179 ασθενείς που αξιολογήθηκαν κατά την παρακολούθηση του ενός μηνός, 15 ασθενείς (8,3%) σταμάτησαν τη θεραπεία, 9 (4,9%) άλλαξαν σε διαφορετικό προμηθευτή κάνναβης και 155 ασθενείς (86,6) συνέχισαν τη θεραπεία (Σχήμα1). Από την τελευταία ομάδα, 93 (60,0) απάντησαν στο ερωτηματολόγιο με 28 ασθενείς (30,1%) να αναφέρουν σημαντική βελτίωση, 50 ασθενείς (53,7%) μέτρια βελτίωση, 6 ασθενείς (6,4%) ελαφριά βελτίωση και 8 (8,6%) καμιά αλλαγή της κατάστασής τους. Καμία από τις μεταβλητές που εισήχθησαν στην ανάλυση πολλών μεταβλητών για να προβλεφθεί η επιτυχία της θεραπείας δεν ήταν στατιστικά σημαντική.
Για να εκτιμηθεί η πιθανή απόκλιση της απόκρισης, συγκρίναμε τα βασικά χαρακτηριστικά μεταξύ 93 ερωτηθέντων και 62 μη ερωτηθέντων στο ερωτηματολόγιο των 6 μηνών. Η πρώτη ομάδα ήταν ελαφρώς μεγαλύτερης ηλικίας (13,7 ± 0,8 έναντι 10,8 ± 0,5, p = 0,004).
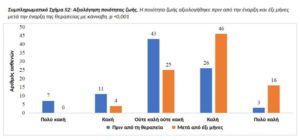
Ποιότητα ζωής. Η ποιότητα ζωής, η διάθεση και η ικανότητα να εκτελούνται καθήκοντα της καθημερινής ζωής αξιολογήθηκαν πριν από τη θεραπεία και σε έξι μήνες. Η καλή ποιότητα ζωής αναφέρθηκε από το 31,3% των ασθενών πριν από την έναρξη της θεραπείας ενώ σε 6 μήνες η καλή ποιότητα ζωής αναφέρθηκε σε 66,8% (p<0,001, Συμπληρωματικό Σχήμα S2). Η θετική διάθεση αναφέρθηκε από τους γονείς σε42% πριν από τη θεραπεία και σε 63,5% μετά από 6 μήνες θεραπείας (p <0,001). Η ικανότητα ανεξάρτητου ντυσίματος και ντους βελτιώθηκε σημαντικά από 26,4% που δεν ανέφερε δυσκολία σε αυτές τις δραστηριότητες πριν από τη θεραπεία σε 42,9% στους έξι μήνες (p <0,001). Παρομοίως, ο καλός ύπνος και η καλή συγκέντρωση αναφέρθηκαν σε 3,3% και 0,0% (αντίστοιχα) πριν από τη θεραπεία και σε 24,7% (p <0,001) και 14,0% (p <0,001) κατά τη διάρκεια της δραστικής θεραπείας (Πίνακας 3).
Τα βελτιωμένα συμπτώματα σε 6 μήνες περιελάμβαναν επιληπτικές κρίσεις, από 13 ασθενείς σε ενεργή θεραπεία, 11 ασθενείς (84,6%) στους 6 μήνες ανέφεραν εξαφάνιση των συμπτωμάτων και δύο ασθενείς ανέφεραν βελτίωση. Η ανησυχία και οι εκρήξεις οργής βελτιώθηκαν σε 72 ασθενείς (91,0%) και 66 (90,3%) αντίστοιχα (Πίνακας 2).
Χρήση φαρμάκων. Τα πιο συχνά συνυπάρχοντα χρόνια φάρμακα στην πρόσληψη ήταν τα αντιψυχωσικά (56,9%), τα αντιεπιληπτικά (26,0%), τα υπνωτικά και τα ηρεμιστικά (14,9%) και τα αντικαταθλιπτικά (10,6%). Από τους 93 ασθενείς που απάντησαν στο ερωτηματολόγιο παρακολούθησης, 67 ανέφεραν τη χρήση χρόνιων φαρμάκων κατά την πρόσληψη. Συνολικά, έξι ασθενείς (8,9%) ανέφεραν αύξηση της κατανάλωσης φαρμάκων, σε 38 ασθενείς (56,7%) η κατανάλωση φαρμάκων παρέμεινε η ίδια και 23 ασθενείς (34,3%) παρουσίασαν μείωση κυρίως των ακόλουθων ομάδων: αντιψυχωσικά, αντιεπιληπτικά, αντικαταθλιπτικά, υπνωτικά και ηρεμιστικά (Πίνακας 4). Τα αντιψυχωσικά, η πλέον διαδεδομένη κατηγορία φαρμάκων που λαμβάνονταν κατά την πρόσληψη (55 ασθενείς, 33,9%). στους 6 μήνες λήφθηκαν στην ίδια δόση από 41 από αυτούς (75), 3 ασθενείς (5,4%) ήταν με μειωμένες δόσεις και 11 ασθενείς (20%) σταμάτησαν να παίρνουν αυτά τα φάρμακα (Πίνακας 4).
Παρενέργειες. Οι πιο συχνές ανεπιθύμητες παρενέργειες, που αναφέρθηκαν σε έξι μήνες από 23 ασθενείς (25,2%, με τουλάχιστον μία παρενέργεια) ήταν: ανησυχία (6 ασθενείς, 6,6%), υπνηλία (3, 3,2% ), αυξημένη όρεξη (3, 3,2%), προβλήματα πέψης (3, 3,2%), ξηροστομία (2,2%) και έλλειψη όρεξης (2,2%).
Από τους 23 ασθενείς που διέκοψαν τη θεραπεία, 17 (73,9%) απάντησαν στο ερωτηματολόγιο παρακολούθησης των έξι μηνών. Οι λόγοι για τη διακοπή της θεραπείας ήταν: κανένα θεραπευτικό αποτέλεσμα (70,6%, δώδεκα ασθενείς) και παρενέργειες (29,4%, πέντε ασθενείς). Ωστόσο, το 41,2% (επτά ασθενείς) των ασθενών που διέκοψαν τη θεραπεία είχε αναφέρει την πρόθεση να επιστρέψουν στην θεραπεία.
Συζήτηση
Η κάνναβη ως θεραπεία για διαταραχές του φάσματος του αυτισμού φαίνεται να είναι καλά ανεκτή, ασφαλής και φαινομενικά αποτελεσματική επιλογή για την ανακούφιση των συμπτωμάτων, κυρίως: των επιληπτικών κρίσεων, των τικ, της κατάθλιψης, της ανησυχίας και της οργής. Η συμμόρφωση με τη θεραπευτική αγωγή φαίνεται να είναι υψηλή, με λιγότερο από το 15% να διακόπτει τη θεραπεία σε 6 μήνες παρακολούθησης. Συνολικά, πάνω από το 80% των γονέων ανέφεραν σημαντική ή μέτρια βελτίωση στη συνολική αξιολόγηση των παιδιών.
Ο ακριβής μηχανισμός των αποτελεσμάτων της κάνναβης σε ασθενείς με ΔΦΑ δεν έχει αποσαφηνιστεί πλήρως. Τα ευρήματα από ζωικά μοντέλα ΔΦΑ δείχνουν πιθανή δυσλειτουργία στην λειτουργία του ενδοκανναβινοειδούς συστήματος (ΕΚΣ)(11-16), μια δυσλειτουργία που προτάθηκε ότι είναι επίσης παρούσα σε ασθενείς με ΔΦΑ(17). Ο μηχανισμός δράσης για την επίδραση της κάνναβης στην ΔΦΑ ενδέχεται να περιλαμβάνει ρύθμιση GABA και μετάδοσης γλουταμινικού. Η ΔΦΑ χαρακτηρίζεται από ανισορροπία διέγερσης και αναστολής της GABAergic και γλουταμινεργικής σηματοδότησης σε διαφορετικές δομές εγκεφάλου(18). Το ΕΚΣ εμπλέκεται στη ρύθμιση της ανισορροπημένης GABAergic(19) και γλουταμινικής μετάδοσης(20).
Άλλος μηχανισμός δράσης μπορεί να είναι μέσω της οξυτοκίνης και της αγγειοπιεστίνης, οι νευροδιαβιβαστές που δρουν ως σημαντικοί διαμορφωτές των κοινωνικών συμπεριφορών(21). Η χορήγηση οξυτοκίνης σε ασθενείς με ΔΦΑ έχει αποδειχθεί ότι διευκολύνει την επεξεργασία των κοινωνικών πληροφοριών, βελτιώνει τη συναισθηματική αναγνώριση, ενισχύει τις κοινωνικές αλληλεπιδράσεις, μειώνει τις επαναλαμβανόμενες συμπεριφορές(22) και αυξάνει την βλεμματική επαφή(23). Η κανναβιδιόλη βρέθηκε να αυξάνει την απελευθέρωση της οξυτοκίνης και της αγγειοπιεστίνης κατά τη διάρκεια δραστηριοτήτων που περιλαμβάνουν κοινωνική αλληλεπίδραση(16).
Τα δύο κύρια δραστικά συστατικά (THC και CBD) μπορεί να έχουν διαφορετικούς μηχανισμούς ψυχοδραστικότητας. Η THC έχει αποδειχθεί προηγουμένως ότι βελτιώνει τα συμπτώματα που χαρακτηρίζουν τους ασθενείς με ΔΦΑ σε άλλους πληθυσμούς που έχουν υποβληθεί σε θεραπεία. Για παράδειγμα, οι ασθενείς ανέφεραν χαμηλότερη συχνότητα άγχους, κινδύνου και κατάθλιψης(24), μετά τη χορήγηση THC, καθώς και βελτιωμένη διάθεση και καλύτερη ποιότητα ζωής γενικά(25). Σε ασθενείς που πάσχουν από άγχος, η THC οδήγησε σε βελτιωμένα επίπεδα άγχους σε σύγκριση με το εικονικό φάρμακο(26) και στους ασθενείς με άνοια, οδήγησε σε μείωση της νυκτερινής κινητικής δραστηριότητας, της βίας(27,28) στη συμπεριφορά και την σοβαρότητα διαταραχών συμπεριφοράς(29). Επιπλέον, η κάνναβη αποδείχθηκε ότι ενισχύει τη διαπροσωπική επικοινωνία(30) και μειώνει τα εχθρικά αισθήματα μέσα στις μικρές κοινωνικές ομάδες(31).
Στη μελέτη μας δείξαμε ότι μια θεραπεία εμπλουτισμένη με CBD των ασθενών με ΔΦΑ μπορεί δυνητικά να οδηγήσει σε βελτίωση των συμπεριφορικών συμπτωμάτων. Αυτά τα ευρήματα συμφωνούν με τα ευρήματα δύο διπλά-τυφλών, ελεγχόμενων με εικονικό φάρμακο διασταυρούμενων μελετών που καταδεικνύουν τις αγχολυτικές ιδιότητες της CBD σε ασθενείς με διαταραχή άγχους(32,33). Σε μία μελέτη, η CBD είχε σημαντική επίδραση στην αυξημένη εγκεφαλική δραστηριότητα στον right posterior cingulate cortex, ο οποίος θεωρείται ότι εμπλέκεται στην επεξεργασία των συναισθηματικών πληροφοριών(32) και στην άλλη μελέτη η προσομοίωση της δημόσιας ομιλίας αξιολογήθηκε σε 24 ασθενείς με διαταραχή κοινωνικού άγχους. Η ομάδα που έλαβε CBD είχε σημαντικά χαμηλότερες βαθμολογίες άγχους από την ομάδα του εικονικού φαρμάκου κατά τη διάρκεια προσομοιωμένης ομιλίας, γεγονός που υποδηλώνει μείωση του άγχους, της γνωστικής εξασθένησης και των παραγόντων δυσφορίας(33).
Η θεραπεία με κάνναβη φαίνεται να είναι ασφαλής και οι ανεπιθύμητες παρενέργειες που αναφέρθηκαν από τους ασθενείς και τους γονείς ήταν μετριοπαθείς και σχετικά εύκολο να αντιμετωπιστούν. Η πλέον επικρατούσα ανεπιθύμητη παρενέργεια που αναφέρθηκαν σε έξι μήνες ήταν η ανησυχία, που εμφανίστηκε σε λιγότερο από το 6,6% των ασθενών. Επιπλέον, η συμμόρφωση με τη θεραπεία ήταν υψηλή και μόνο λιγότεροι από 5 σταμάτησαν την θεραπεία λόγω των παρενεργειών. Πιστεύουμε ότι το προσεκτικό πρόγραμμα τιτλοδότησης, ειδικά στον παιδικό πληθυσμό με ΔΦΑ, είναι σημαντικό για τη διατήρηση ενός χαμηλού ποσοστού παρενεργειών και την αύξηση του ποσοστού επιτυχίας. Επιπλέον, πιστεύουμε ότι μια επαγγελματική διδασκαλία και λεπτομερείς συνεδρίες κατάρτισης των γονέων είναι εξαιρετικά σημαντικές για την μείωση των επιπτώσεων από τις ανεπιθύμητες παρενέργειες.
Τα παρόντα συμπεράσματα θα πρέπει να ερμηνεύονται με προσοχή για διάφορους λόγους. Πρώτον, πρόκειται για μια μελέτη παρατήρησης χωρίς ομάδα ελέγχου και συνεπώς δεν μπορεί να διαπιστωθεί καμιά αιτιότητα μεταξύ της θεραπείας με κάνναβη και της βελτίωσης της ευημερίας των ασθενών. Τα παιδιά των γονέων που αναζητούν θεραπεία κάνναβης ενδέχεται να μην αποτελούν αντιπροσωπευτικό δείγμα των ασθενών με τη συγκεκριμένη νόσο (μεροληψία αυτοεπιλογής). Δεν έχουμε επιβεβαιώσει επισήμως τη διάγνωση ΔΦΑ, ωστόσο όλα τα παιδιά που συμπεριλήφθηκαν στην μελέτη είχαν προηγουμένως διαγνωστεί με ΔΦΑ από πιστοποιημένο νευρολόγο ή ψυχίατρο, όπως απαιτείται από το Υπουργείο Υγείας πριν από την έναρξη της θεραπείας με βάση την κάνναβη.
Αυτή η μελέτη βασίστηκε σε μια υποκειμενική αυτοαναφορά της παρατήρησης του γονέα του ασθενούς και όχι στους ίδιους τους ασθενείς. Αυτές οι αναφορές, με υποκειμενικές μεταβλητές όπως η ποιότητα ζωής, η διάθεση και τα γενικά αποτελέσματα, μπορεί να είναι προκατειλημμένες από τη γνώμη της μητέρας για τη θεραπεία. Επιπλέον, παρόλο που το αποτέλεσμα αξιολογήθηκε σε έξι μήνες, δεν μπορεί να αποκλειστεί η πιθανότητα των διογκωμένων προσδοκιών της νέας θεραπείας “θαύμα”. Το ποσοστό απόκρισης στο ερωτηματολόγιο σε 6 μήνες ήταν 60%, επομένως οι εκτιμήσεις της αποτελεσματικότητας και της ασφάλειας της θεραπείας μπορεί να είναι προκατειλημμένες. Ωστόσο, η υψηλή συμμόρφωση (άνω του 80%) με τη θεραπεία παρέχει μια καλή απόδειξη για την ικανοποίηση των ασθενών και των γονέων από τη θεραπεία.
Ενώ αυτή η μελέτη υποδεικνύει ότι η θεραπεία με κάνναβη είναι ασφαλής και μπορεί να βελτιώσει τα συμπτώματα στην ΔΦΑ και να βελτιώσει την ποιότητα ζωής του ασθενούς με ΔΦΑ, πιστεύουμε ότι διπλά τυφλές ελεγχόμενες με εικονικό φάρμακο δοκιμές είναι ζωτικής σημασίας για την καλύτερη κατανόηση του αποτελέσματος της κάνναβης στους ασθενείς με ΔΦΑ.
Μέθοδοι
Μελέτη πληθυσμού. Υπάρχουν σήμερα περισσότεροι από 35.000 ασθενείς που έχουν εγκριθεί για την ιατρική χρήση της κάνναβης στο Ισραήλ και 15.000 (~42.8%) από αυτούς υποβάλλονται σε θεραπεία από τα σκευάσματα της Tikun-Olam Ltd. (TO), τη μεγαλύτερη εθνική εταιρεία παροχής κάνναβης για ιατρική χρήση. Η μελέτη αυτή περιελάμβανε όλους τους ασθενείς που έλαβαν άδεια χρήσης κάνναβης με την ΤΟ με διάγνωση αυτισμού κατά τα έτη 2015-2017.
Κατά τη διάρκεια της διαδικασίας τακτικής θεραπείας στην κλινική κάνναβης, όλοι οι πρόθυμοι ασθενείς υποβλήθηκαν σε εκτεταμένη αρχική αξιολόγηση και η κατάστασή της υγείας τους αξιολογήθηκε περιοδικά από την ομάδα θεραπείας. Κατά τη διάρκεια της συνεδρίασης, η νοσοκόμα αξιολόγησε ένα πλήρες ιατρικό ιστορικό. Οι γονείς του ασθενούς ερωτήθηκαν από τη νοσοκόμα και συμπλήρωσαν ένα ιατρικό ερωτηματολόγιο, το οποίο περιελάμβανε τους ακόλουθους τομείς: δημογραφικά στοιχεία, συννοσηρότητα, συνήθειες, παράλληλα φάρμακα, μετρήσεις ποιότητας ζωής και λεπτομερή πίνακα ελέγχου συμπτωμάτων. Μετά την πρόσληψη, η νοσοκόμα ενημέρωσε για το σχέδιο θεραπείας.
Καθεστώς θεραπείας. Η θεραπεία στην πλειονότητα των ασθενών βασίστηκε σε έλαιο κάνναβης (ένα εκχύλισμα μια ποικιλίας με υψηλή περιεκτικότητα σε CBD διαλύεται σε ελαιόλαδο σε αναλογία THC:CBD 1:20, 30% CBD και 1,5% THC) και υποβλήθηκε σε εξατομικευμένη τιτλοδότηση. Η δόση έναρξης ήταν μία υπογλώσσια σταγόνα τρεις φορές την ημέρα με μία σταγόνα ελαίου (0,05 ml) που περιείχε 15mg CBD και 0,75mg Δ9-THC. Το έλαιο περιείχε 45% ελαιόλαδο, 30% CBD, 1,5% THC, <1,5% CBC, 0,5% CBG, <0,5% CBDV και <0,1% CBN. Τα υπόλοιπα συστατικά ήταν τερπένια, φλαβονοειδή, κηροί και χλωροφύλλη.
Σε ασθενείς που ανέφεραν υψηλή ευαισθησία σε φάρμακα που είχαν χρησιμοποιηθεί στο παρελθόν, η θεραπεία ξεκίνησε με έλαιο που περιείχε 1:20 15% CBD και 0,75% THC. Σε ασθενείς με σοβαρές διαταραχές του ύπνου, μετά την αρχική φάση της θεραπείας, ένα 3% THC έλαιο προστέθηκε στην βραδινή δόση. Σε περιπτώσεις με σημαντική επιθετική ή βίαιη συμπεριφορά, προστέθηκε επίσης ένα 3% THC έλαιο.
Η δόση αυξήθηκε βαθμιαία για κάθε ασθενή ανάλογα με την επίδραση του ελαίου κάνναβης στα στοχευόμενα συμπτώματα σύμφωνα με το σχέδιο θεραπείας και την ανοχή του κάθε ασθενούς. Η εύρεση της βέλτιστης δόσης μπορεί να διαρκέσει έως δύο μήνες και η δοσολογία έχει μεγάλη διακύμανση: από μία σταγόνα τρεις φορές την ημέρα έως και 20 σταγόνες τρεις φορές την ημέρα του ίδιου προϊόντος.
Μετά από ένα μήνα, η θεραπευτική ομάδα έρχεται σε επαφή με τους γονείς για να παρακολουθήσει την εξέλιξη της θεραπείας. Σε έξι μήνες οι ασθενείς υποβλήθηκαν σε μια πρόσθετη αξιολόγηση της έντασης των συμπτωμάτων, των παρενεργειών και της ποιότητας ζωής.
Αποτελέσματα μελέτης. Για την ανάλυση ασφάλειας αξιολογήσαμε τη συχνότητα των ακόλουθων παρενεργειών σε έναν μήνα και σε έξι μήνες: φυσιολογικές επιδράσεις – πονοκέφαλοι, ζάλη, ναυτία, έμετος, πόνος στο στομάχι, αίσθημα παλμών στην καρδιά, πτώση της αρτηριακής πίεσης, πτώση σακχάρου, υπνηλία, ρίγη, φαγούρα, κόκκινα/ερεθισμένα μάτια, ξηροστομία, βήχας, αυξημένη όρεξη, θολή όραση, ομιλία. Γνωστικές παρενέργειες – ανησυχία, φόβος, ψυχοδραστικές επιπτώσεις, παραισθήσεις, σύγχυση και αποπροσανατολισμός, μειωμένη συγκέντρωση, μειωμένη μνήμη ή άλλα. Οι γονείς των ασθενών κλήθηκαν να παράσχουν λεπτομέρειες για την επίπτωση, τη διάρκεια και τη σοβαρότητα της ανεπιθύμητης παρενέργειας που αναφέρθηκε.
Για την ανάλυση της αποτελεσματικότητας χρησιμοποιήσαμε την προσέγγιση της συνολικής αξιολόγησης όπου οι γονείς των ασθενών ρωτήθηκαν: “Πώς θα αξιολογούσατε τη γενική επίδραση της κάνναβης στην κατάσταση του παιδιού σας;” οι επιλογές ήταν: σημαντική βελτίωση, μέτρια βελτίωση, ελαφριά βελτίωση, καμία αλλαγή, υποβάθμιση, μέτρια επιδείνωση και σημαντική επιδείνωση. Η αξιολόγηση της σοβαρότητας των συμπτωμάτων αυτισμού περιελάμβανε τα ακόλουθα στοιχεία: ανησυχία, εκρήξεις οργής, αδημονία, προβλήματα ομιλίας, γνωστική εξασθένηση, άγχος, ακράτεια, κατάθλιψη και πολλά άλλα. Η ποιότητα ζωής αξιολογήθηκε σε κλίμακα Likert scale με διακύμανση από πολύ κακή έως κακή, ούτε κακή ούτε καλή και καλή έως πολύ καλή(34).
Η μελέτη εγκρίθηκε από την επιτροπή Soroka University Medical Centre Ethics Committee και λόγω της φύσης της ανάλυσης δεδομένων με βάση τα κλινικά δεδομένα που λαμβάνονται συνήθως, διαπιστώθηκε ότι δεν απαιτείται συναίνεση κατόπιν ενημέρωσης. Όλες οι μέθοδοι πραγματοποιήθηκαν σύμφωνα με τις σχετικές θεσμικές και διεθνείς κατευθυντήριες γραμμές και κανονισμούς για την έρευνα.
Στατιστική ανάλυση. Η συνεχής μεταβλητή με την κανονική κατανομή παρουσιάστηκε ως μέτρο με τυπική απόκλιση. Οι συνήθεις μεταβλητές ή οι συνεχείς μεταβλητές με μη φυσιολογική κατανομή παρουσιάστηκαν ως διάμεσοι με μια κλίμακα interquartile range (IQR). Οι κατηγορικές μεταβλητές παρουσιάστηκαν ως μετρήσεις και τοις εκατό του συνόλου.
Χρησιμοποιήσαμε t-test και paired t-test για την ανάλυση των συνεχών μεταβλητών με κανονική κατανομή. Το non-parametric Mann-Whitney U test και το paired Wilcoxon test χρησιμοποιήθηκαν κάθε φορά που δεν μπορούσαν να ικανοποιηθούν οι παραμετρικές υποθέσεις.
Χρησιμοποιήσαμε την logistic regression για την πολυπαραγοντική ανάλυση των παραγόντων που σχετίζονται με την επιτυχία της θεραπείας. Έχουμε συμπεριλάβει τις ακόλουθες μεταβλητές στα μοντέλα με βάση κλινικές εκτιμήσεις: ηλικία, φύλο, αριθμός χρόνιων φαρμάκων, πλήθος συμπτωμάτων και τα τρία πιο διαδεδομένα συμπτώματα: ανησυχία, εκρήξεις οργής και διέγερση (ως διχοτομική μεταβλητή – ναι / όχι ), όπως αντικατοπτρίζεται στη φόρμα εισαγωγής.
Η τιμή Ρ <0,05 θεωρήθηκε στατιστικά σημαντική. Όλες οι αναλύσεις πραγματοποιήθηκαν στο Clinical Research Centre, Soroka University Medical Centre, Beer-Sheva, Ισραήλ χρησιμοποιώντας IBM SPSS version 22 (SPSS, Chicago, IL).
Δηλώσεις.Η μελέτη εγκρίθηκε από την επιτροπή Soroka University Medical Center Ethics Committee (αριθμός μελέτης: SCRC-0415-15) και η ανάγκη για ενημερωμένη συγκατάθεση απομακρύνθηκε λόγω της αναδρομικής φύσης της ανάλυσης δεδομένων.
Διαθεσιμότητα δεδομένων
Το σύνολο των δεδομένων που δημιουργήθηκε ή/και αναλύθηκε κατά τη διάρκεια της τρέχουσας μελέτης δεν είναι διαθέσιμο στο κοινό λόγω του ιατρικού απόρρητου, αλλά είναι διαθέσιμα από τον πρώτο συντάκτη κατόπιν εύλογου αιτήματος που συνοψίζεται εν αναμονή της έγκρισης του IRB.
Βιβλιογραφικές αναφορές
1. Bax M. “Autism” (Αυτισμός) Dev Med Child Neurol. 1994 Aug;36(8):659-60.
https://www.ncbi.nlm.nih.gov/pubmed/8050620
2. “California Health and Human Services Agency, Department of Developmental Services Sacramento, 1999” (Οργανισμός Υγείας και Ανθρωπίνων Υπηρεσιών της Καλιφόρνια, Τμήμα Αναπτυξιακών Υπηρεσιών Σακραμέντο, 1999)
https://www.dds.ca.gov/
3. Croen LA, Grether JK, Hoogstrate J, Selvin S “The changing prevalence of autism in California” (Η μεταβαλλόμενη επικράτηση του αυτισμού στην Καλιφόρνια) J Autism Dev Disord. 2002 Jun;32(3):207-15.
https://www.ncbi.nlm.nih.gov/pubmed/12108622
4. Boyle CA, Boulet S, Schieve LA, Cohen RA, Blumberg SJ, Yeargin-Allsopp M, Visser S, Kogan MD “Trends in the prevalence of developmental disabilities in US children, 1997-2008” (Τάσεις στην επικράτηση αναπτυξιακών αναπηριών σε παιδιά στις ΗΠΑ, 1997-2008) Pediatrics. 2011 Jun;127(6):1034-42.
https://www.ncbi.nlm.nih.gov/pubmed/21606152
5. Sebastian Lundström, Abraham Reichenberg, Henrik Anckarsäter, Paul Lichtenstein, Christopher Gillberg “Autism phenotype versus registered diagnosis in Swedish children: prevalence trends over 10 years in general population samples” (Φαινότυπος αυτισμού έναντι καταχωρημένης διάγνωσης σε παιδιά στην Σουηδία: τάσεις επικράτησης για πάνω από 10 χρόνια σε δείγματα γενικού πληθυσμού) BMJ 2015;350:h1961.
https://www.bmj.com/content/350/bmj.h1961
6. Anne Masi, Marilena M. DeMayo, Nicholas Glozier, Adam J. Guastella “An Overview of Autism Spectrum Disorder, Heterogeneity and Treatment Options” (Μια επισκόπηση της διαταραχής στο φάσμα του αυτισμού, της ετερογένειας και των επιλογών θεραπείας) Neurosci Bull. 2017 Apr;33(2):183–193.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5360849/
7. Aran A, Cassuto H, Lubotzky A, Wattad N, Hazan E “Brief Report: Cannabidiol-Rich Cannabis in Children with Autism Spectrum Disorder and Severe Behavioral Problems-A Retrospective Feasibility Study” (Σύντομη έκθεση: Πλούσια σε κανναβιδιόλη κάνναβη σε παιδιά με διαταραχή στο φάσμα του αυτισμού και σοβαρά προβλήματα συμπεριφοράς – Αναδρομική μελέτη σκοπιμότητας) J Autism Dev Disord. 2019 Mar;49(3):1284-1288.
https://www.ncbi.nlm.nih.gov/pubmed/30382443
8. Christopher Anderson, Victoria F. Evans, Thomas B. DeMarse, Marcelo Febo, Cynthia R. Johnson, Paul Carney “Cannabidiol for the Treatment of Drug-Resistant Epilepsy in Children: Current State of Research” (Κανναβιδιόλη για τη θεραπεία της ανθεκτικής στα φάρμακα επιληψίας στα παιδιά: Τρέχουσα κατάσταση της έρευνας) Journal of pediatric neurology: JPN Jan 2017;15(4).
https://www.researchgate.net/publication/312644044_Cannabidiol_for_the_Treatment_of_Drug-Resistant_Epilepsy_in_Children_Current_State_of_Research
9. René Kurz, K. R. Blaas “Use of dronabinol (delta-9-THC) in autism: A prospective single-case-study with an early infantile autistic child” (Χρήση του dronabinol (δέλτα-9-THC) στον αυτισμό: Μια προοπτική μεμονωμένη μελέτη με ένα παιδί με πρόωρο παιδικό αυτισμό) Cannabinoids 2010;5(4):4-6.
https://www.semanticscholar.org/paper/Use-of-dronabinol-(delta-9-THC)-in-autism%3A-A-with-Kurz-Blaas/f5586116b4f10840131970c85663770a504ee42b
10. Kruger, Tarah, Christophersen, Ed “An open label study of the use of dronabinol (Marinol) in the management of treatment-resistant self-injurious behavior in 10 retarded adolescent patients” (Μια μελέτη ανοικτής ετικέτας σχετικά με τη χρήση του dronabinol (Marinol) στη διαχείριση της ανθεκτικής σε θεραπεία αυτοτραυματικής συμπεριφοράς σε 10 εφήβους ασθενείς με νοητική υστέρηση) Journal of Developmental & Behavioral Pediatrics. Octr 2006;27(5):433.
https://journals.lww.com/jrnldbp/Citation/2006/10000/An_Open_Label_Study_of_the_Use_of_Dronabinol.29.aspx
11. Mauro Maccarrone, Silvia Rossi, Monica Bari, Valentina De Chiara, Cinzia Rapino, Alessandra Musella, Giorgio Bernardi, Claudia Bagni, Diego Centonze “Abnormal mGlu 5 Receptor/Endocannabinoid Coupling in Mice Lacking FMRP and BC1 RNA” (Μη φυσιολογική σύζευξη υποδοχέα mGlu5 / ενδοκανναβινοειδούς σε ποντικούς που στερούνται FMRP και BC1 RNA) Neuropsychopharmacology.2010 Jun;35(7):1500–1509.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3055456/
12. Kwang-Mook Jung, Marja Sepers, Christopher M. Henstridge, Olivier Lassalle, Daniela Neuhofer, Henry Martin, Melanie Ginger, Andreas Frick, Nicholas V. DiPatrizio, Ken Mackie, Istvan Katona, Daniele Piomelli, Olivier J. Manzonic “Uncoupling of the endocannabinoid signalling complex in a mouse model of fragile X syndrome” (Αποσύνδεση του συμπλόκου σηματοδότησης ενδοκανναβινοειδούς σε μοντέλο ποντικού ευαίσθητου συνδρόμου Χ) Nat Commun. 2012 Sep 25;3:1080.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3657999/
13. Busquets-Garcia A1, Gomis-González M, Guegan T, Agustín-Pavón C, Pastor A, Mato S, Pérez-Samartín A, Matute C, de la Torre R, Dierssen M, Maldonado R, Ozaita A. “Targeting the endocannabinoid system in the treatment of fragile X syndrome” (Στόχευση του ενδοκανναβινοειδούς συστήματος στη θεραπεία του συνδρόμου εύθραυστου Χ) Nat Med. 2013 May;19(5):603-7.
https://www.ncbi.nlm.nih.gov/pubmed/23542787
14. Qing-Rong Liu, Chun-Hung Pan, Akitoyo Hishimoto, Chuan-Yun Li, Zheng-Xiong Xi, Alvaro Llorente-Berzal, Maria-Paz Viveros, Hiroki Ishiguro, Tadao Arinami, Emmanuel Shan Onaivi, George R. Uhl “Species differences in cannabinoid receptor 2 (CNR2 gene): identification of novel human and rodent CB2 isoforms, differential tissue expression, and regulation by cannabinoid receptor ligands” (Διαφορές ειδών στον κανναβινοειδή υποδοχέα 2 (γονίδιο CNR2): ταυτοποίηση νέων ισομορφών CB2 άνθρωπο και τρωκτικό, διαφορική έκφραση ιστού και ρύθμιση από συνδέτες υποδοχέα κανναβινοειδών) Genes Brain Behav. 2009 Jul;8(5):519–530.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3389515/
15. Kerr DM, Downey L, Conboy M, Finn DP, Roche M “Alterations in the endocannabinoid system in the rat valproic acid model of autism” (Μεταβολές στο ενδοκανναβινοειδές σύστημα στο μοντέλο αυτισμού αρουραίου με βαλπροϊκό οξύ) Behav Brain Res. 2013 Jul 15;249:124-32.
https://www.ncbi.nlm.nih.gov/pubmed/23643692
16. Don Wei, DaYeon Lee, Conor D. Cox, Carley A. Karsten, Olga Peñagarikano, Daniel H. Geschwind, Christine M. Gall, Daniele Piomellia “Endocannabinoid signaling mediates oxytocin-driven social reward” (Η ενδοκανναβινοειδής σηματοδότηση διαμεσολαβεί στην κοινωνική ανταμοιβή που βασίζεται στην οξυτοκίνη) Proc Natl Acad Sci USA. 2015 Nov 10;112(45):14084–14089.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4653148/
17. Siniscalco D, Sapone A, Giordano C, Cirillo A, de Magistris L, Rossi F, Fasano A, Bradstreet JJ, Maione S, Antonucci N “Cannabinoid receptor type 2, but not type 1, is up-regulated in peripheral blood mononuclear cells of children affected by autistic disorders” (Ο κανναβινοειδής υποδοχέας τύπου 2, αλλά όχι ο τύπου 1, ρυθμίζεται ανοδικά σε μονοπύρηνα κύτταρα περιφερικού αίματος σε παιδιά με αυτιστικές διαταραχές) J Autism Dev Disord. 2013 Nov;43(11):2686-95.
https://www.ncbi.nlm.nih.gov/pubmed/23585028
18. Erica Zamberletti, Marina Gabaglio, Daniela Parolaro “The Endocannabinoid System and Autism Spectrum Disorders: Insights from Animal Models” (Το ενδοκανναβινοειδές σύστημα και οι διαταραχές στο φάσμα του αυτισμού: Παρατηρήσεις από ζωικά μοντέλα) Int J Mol Sci. 2017 Sep;18(9):1916.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5618565/
19. Piomelli D “The molecular logic of endocannabinoid signalling” (Η μοριακή λογική της ενδοκανναβινοειδούς σηματοδότησης) Nat Rev Neurosci. 2003 Nov;4(11):873-84.
https://www.ncbi.nlm.nih.gov/pubmed/14595399
20. Colizzi M, McGuire P, Pertwee RG, Bhattacharyya S “Effect of cannabis on glutamate signalling in the brain: A systematic review of human and animal evidence” (Επίδραση της κάνναβης στην σηματοδότηση γλουταμινικού στον εγκέφαλο: Μια συστηματική ανασκόπηση των ανθρώπινων και ζωικών στοιχείων) Neurosci Biobehav Rev. 2016 May;64:359-81.
https://www.ncbi.nlm.nih.gov/pubmed/26987641
21. Meyer-Lindenberg A, Domes G, Kirsch P, Heinrichs M “Oxytocin and vasopressin in the human brain: social neuropeptides for translational medicine” (Οξυτοκίνη και βαζοπρεσίνη στον ανθρώπινο εγκέφαλο: κοινωνικά νευροπεπτίδια για τη μεταφραστική ιατρική) Nat Rev Neurosci.2011 Aug 19;12(9):524-38.
https://www.ncbi.nlm.nih.gov/pubmed/21852800
22. Joshua J. Green, Eric Hollander “Autism and oxytocin: New developments in translational approaches to therapeutics” (Αυτισμός και οξυτοκίνη: Νέες εξελίξεις στις μεταφραστικές προσεγγίσεις στην θεραπευτική) Neurotherapeutics. 2010 Jul;7(3):250–257.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5084228/
23. I-Fan Lin, Makio Kashino, Haruhisa Ohta, Takashi Yamada, Masayuki Tani, Hiromi Watanabe, Chieko Kanai, Taisei Ohno, Yuko Takayama, Akira Iwanami, Nobumasa Kato “The effect of intranasal oxytocin versus placebo treatment on the autonomic responses to human sounds in autism: a single-blind, randomized, placebo-controlled, crossover design study” (Η επίδραση της ενδορρινικής οξυτοκίνης έναντι της θεραπείας με εικονικό φάρμακο στις αυτόνομες αποκρίσεις στους ανθρώπινους ήχους στον αυτισμό: μια μονή, τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη διασταύρωσης) Mol Autism. 2014;5:20.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4015306/
24. Radbruch L, Nauck F “[A review of side effects and complications with cannabinoid treatment]” [Article in German] ([Ανασκόπηση παρενεργειών και επιπλοκών με θεραπεία με κανναβινοειδή] [Άρθρο στα γερμανικά]) Schmerz. 2003 Aug;17(4):274-9.
https://www.ncbi.nlm.nih.gov/pubmed/12923677
25. Walsh D, Nelson KA, Mahmoud FA “Established and potential therapeutic applications of cannabinoids in oncology” (Καθιερωμένες και πιθανές θεραπευτικές εφαρμογές κανναβινοειδών στην ογκολογία) Support Care Cancer. 2003 Mar;11(3):137-43.
https://www.ncbi.nlm.nih.gov/pubmed/12618922
26. Fabre LF, McLendon D “The efficacy and safety of nabilone (a synthetic cannabinoid) in the treatment of anxiety” (Η αποτελεσματικότητα και η ασφάλεια του nabilone (ένα συνθετικό κανναβινοειδές) στη θεραπεία του άγχους) J Clin Pharmacol. 1981 Aug-Sep;21(S1):377S-382S.
https://www.ncbi.nlm.nih.gov/pubmed/6117575
27. Walther S, Schüpbach B, Seifritz E, Homan P, Strik W “Randomized, controlled crossover trial of dronabinol, 2.5 mg, for agitation in 2 patients with dementia” (Τυχαία, ελεγχόμενη δοκιμή διασταύρωσης του dronabinol, 2,5 mg, για ανησυχία σε 2 ασθενείς με άνοια) J Clin Psychopharmacol. 2011 Apr;31(2):256-8.
https://www.ncbi.nlm.nih.gov/pubmed/21364345
28. Walther S, Mahlberg R, Eichmann U, Kunz D “Delta-9-tetrahydrocannabinol for nighttime agitation in severe dementia” (Δέλτα-9-τετραϋδροκανναβινόλη για νυκτερινή ανησυχία σε σοβαρή άνοια) Psychopharmacology (Berl). 2006 May;185(4):524-8.
https://www.ncbi.nlm.nih.gov/pubmed/16521031
29. Volicer L, Stelly M, Morris J, McLaughlin J, Volicer BJ “Effects of dronabinol on anorexia and disturbed behavior in patients with Alzheimer’s disease” (Επιδράσεις της dronabinol στην ανορεξία και σε διαταραγμένη συμπεριφορά σε ασθενείς με Νόσο του Alzheimer) Int J Geriatr Psychiatry. 1997 Sep;12(9):913-9.
https://www.ncbi.nlm.nih.gov/pubmed/9309469
30. Salzman C, Kochansky GE, Van Der Kolk BA, Shader RI “The effect of marijuana on small group process” (Η επίδραση της κάνναβης στη διαδικασία μικρών ομάδων) Am J Drug Alcohol Abuse. 1977;4(2):251-5.
https://www.ncbi.nlm.nih.gov/pubmed/612199
31. Salzman C, Van Der Kolk BA, Shader RI “Marijuana and hostility in a small-group setting” (Κάνναβη και εχθρότητα σε ένα περιβάλλον μικρής ομάδας) Am J Psychiatry. 1976 Sep;133(9):1029-33.
https://www.ncbi.nlm.nih.gov/pubmed/961922
32. Crippa JA, Derenusson GN, Ferrari TB, Wichert-Ana L, Duran FL, Martin-Santos R, Simões MV, Bhattacharyya S, Fusar-Poli P, Atakan Z, Santos Filho A, Freitas-Ferrari MC, McGuire PK, Zuardi AW, Busatto GF, Hallak JE “Neural basis of anxiolytic effects of cannabidiol (CBD) in generalized social anxiety disorder: a preliminary report” (Νευρωνική βάση αγχολυτικών επιδράσεων της κανναβιδιόλης (CBD) στη γενικευμένη διαταραχή κοινωνικού άγχους: μια προκαταρκτική έκθεση) J Psychopharmacol. 2011 Jan;25(1):121-30.
https://www.ncbi.nlm.nih.gov/pubmed/20829306
33. Mateus M Bergamaschi, Regina Helena Costa Queiroz, Marcos Hortes Nisihara Chagas, Danielle Chaves Gomes de Oliveira, Bruno Spinosa De Martinis, Flávio Kapczinski, João Quevedo, Rafael Roesler, Nadja Schröder, Antonio E Nardi, Rocio Martín-Santos, Jaime Eduardo Cecílio Hallak, Antonio Waldo Zuardi, José Alexandre S Crippa “Cannabidiol Reduces the Anxiety Induced by Simulated Public Speaking in Treatment-Naïve Social Phobia Patients” (Η κανναβιδιόλη μειώνει το άγχος που προκαλείται από την προσομοίωση της δημόσιας ομιλίας σε ασθενείς που δεν έχουν λάβει θεραπεία για την κοινωνική φοβία) Neuropsychopharmacology. 2011 May;36(6):1219–1226.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3079847/
34. [Δεν αναγράφονται συγγραφείς] “Development of the World Health Organization WHOQOL-BREF quality of life assessment. The WHOQOL Group” (Ανάπτυξη της αξιολόγησης της ποιότητας ζωής της WHOQOL-BREF της Παγκόσμιας Οργάνωσης Υγείας. Η ομάδα WHOQOL) Psychol Med. 1998 May, 28 (3): 551-8.
https://www.ncbi.nlm.nih.gov/pubmed/9626712
Ευχαριστίες
Η Tikun Olam LTD. υποστήριξε την μελέτη.
Συνεισφορές συγγραφέων
L.B.L.S., V.N. και R.M. σχεδίασαν τη μελέτη. N.S. συνέλλεξε τα δεδομένα, L.B.L.S. και V.N. ανέλυσαν τα δεδομένα, L.B.L.S. έγραψε το χειρόγραφο, V.N. και G.M. εξέτασαν και ενέκριναν το χειρόγραφο.
Επιπλέον πληροφορίες
Συμπληρωματικές πληροφορίες συνοδεύουν το παρόν έγγραφο στη διεύθυνση https://doi.org/10.1038/s41598-018-37570-y
Συναγωνιστικά Ενδιαφέροντα: L.B.L.S. και N.S. είναι υπάλληλοι της Tikun-Olam Ltd., V.N. είναι μέλος του επιστημονικού συμβουλευτικού συμβουλίου της Tikun Olam Ltd. R.M. και G.M. δεν έχουν συγκρούσεις συμφερόντων που σχετίζονται με το σημερινό χειρόγραφο.
Σημείωση εκδότη: Το Springer Nature παραμένει ουδέτερο όσον αφορά τους ισχυρισμούς περί δικαιοδοσίας σε δημοσιευμένους χάρτες και θεσμικές σχέσεις.
Ανοιχτή πρόσβαση: Αυτό το άρθρο έχει άδεια χρήσης υπό Creative Commons Attribution 4.0 International
http://creativecommons.org/licenses/by/4.0/